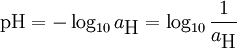ما هو ( الأس الهيدروجيني pH ) أو درجة الحموضة أو الباهاء أو ( القوة الهيدروجينية power of hydrogen or pH ويرمز لها بالرمز pH ) ..وهي القياس الذي يحدد ما إذا كان السائل حمضا أم قاعدة ( قلوي ) أم متعادلا..
الأس الهيدروجيني
|
||||||||||||||||||||||||||||||||||||||||
|
دليل شوادر الهيدروجين (الأس الهيدروجيني) أو درجة الحموضة أو الباهاء أو القوة الهيدروجينية بالإنجليزية: power of hydrogen or pH ويرمز لها بالرمز pH هي القياس الذي يحدد ما إذا كان السائل حمضا أم قاعدة أم متعادلا. حيث تعتير السوائل ذات درجة حموضة أقل من 7 أحماضا وتعتبر السوائل ذات درجة حموضة أعلى من 7 محلولا قلويا أو قواعد. أما درجة الحموضة 7 فهي تعتبر متعادلة وهي تساوي حموضة الماء النقي على درجة حرارة 25 مئوية. ويمكن معرفة درجة حموضة أي محلول باستخدام مؤشر الرقم الهيدروجيني
الأُسُّ الهَيْدرُوجيني رقم يستخدمه الكيميائيون لبيان تركز أيونات الهيدروجين في محلول ما. ويتراوح الأس الهيدروجيني عامة من صفر إلى 14. الأس الهيدروجيني الذي تحت (7) يدل على أن المحلول حمضي والأس الهيدروجيني الذي فوق (7) يدل على أن المحلول قاعدي (قلويّ). المحلول المحايد مثل الماء النقي، لا هو حمضي، ولا قاعدي، والأس الهيدروجيني له (7) عند درجة 25°. والحروف ب هـ (pH) اختصار لجهد الهيدروجين.[1]
اخترع عالم الكيمياء العضوية سورن پدر لوريتس سورنسن Søren Peder Lauritz Sørensen نظام الأس الهيدروجيني عام 1909م. ويُعرَّف الأس الهيدروجيني لمحلول ما على أنه اللوغاريتم السلبي، (للأساس 10)، لتركيز أيونات الهيدروجين فيه. ويعبر عن هذا التركيز بعدد مولات أيونات الهيدروجين في لتر من المحلول. انظر: الجزيء الجرامي. فالمحلول ذو الأس الهيدروجيني (6)، يحوي 10-6 (واحد على المليون) من مول واحد من أيونات الهيدروجين لكل لتر.
يقاس الأس الهيدروجيني غالبًا بعداد الأس الهيدروجيني الإلكتروني، أو بصبغات خاصة تسمى الدلائل الحمضية والقاعدية . ويعتمد لون الدليل على تركيز أيونات الهيدروجين. وتحتوي ورقة الأس الهيدروجيني على دلائل عديدة تُغير اللون عند كل أس هيدروجيني مختلف. ويعتمد كثير من التفاعلات الكيميائية على الأس الهيدروجيني، كما يستخدم الأس الهيدروجيني لتحليل إفرازات الجسم ولاختبار صلاحية التربة لمحاصيل معينة، وللأغراض الصناعية المتعددة.
فهرست
تعريف pH الرياضي
درجة الحموضة (يسمونها أحيانا الرقم الهيدروجيني) هي سالب لوغاريثم تركيز الهيدروجين في محلول ما ويشير الي درجة حموضة ذلك المحلول، ويمكن قياسه عن طريق مؤشر الرقم الهيدروجيني.
يستخدم القانون اللوغاريتمي لتحديد قيمة pH بدون وحدات:
حيث aH يمثل نشاط ايونات الهيدروجين.
الاستخدامات
| المؤشر | لون الأس الهيدروجيني المنخفض | مدى انتقال الأس الهيدروجيني | لون الأس الهيدروجيني المرتفع |
|---|---|---|---|
| Thymol blue (أول انتقال) | أحمر | 1.2–2.8 | أصفر |
| Methyl red | أحمر | 4.4–6.2 | أصفر |
| Bromothymol blue | أصفر | 6.0–7.6 | أزرق |
| Thymol blue (second transition) | yellow | 8.0–9.6 | blue |
| Phenolphthalein | لا لون لون | 8.3–10.0 | أرجواني |
الأس الهيدروجيني في الطبيعة
الأجهزة الحيوية
| القِسم | الأس الهيدروجيني |
|---|---|
| الحامض المعدي | 1 |
| يحلول | 4.5 |
| حبيبات الخلايا أليفة الكروم | 5.5 |
| الجلد البشري | 5.5 |
| البول | 6.0 |
| H2O متعادل عند 37 °C | 6.81 |
| سائل هيولي | 7.2 |
| السائل الدماغي الشوكي (CSF) | 7.3 |
| الدم | 7.34-7.45 |
| موجدة المتقدرات | 7.5 |
| افرازات الپنكرياس | 8.1 |
بالأزرق، يمكن تقدير الأس الهيدروجيني pH من تركزات زيد القاعدة base excess (be) معروفة وبيكربونات (HCO3) بالمعادلة التالية:[5]
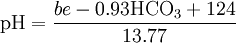
انظر أيضاً
الهامش
- ^ الأس الهيدروجيني، الموسوعة المعرفية الشاملة
- ^ Boron, Walter, F.; Boulpaep, E.L. (2004). Medical Physiology: A Cellular And Molecular Approaoch. Elsevier/Saunders. ISBN 1-4160-2328-3.
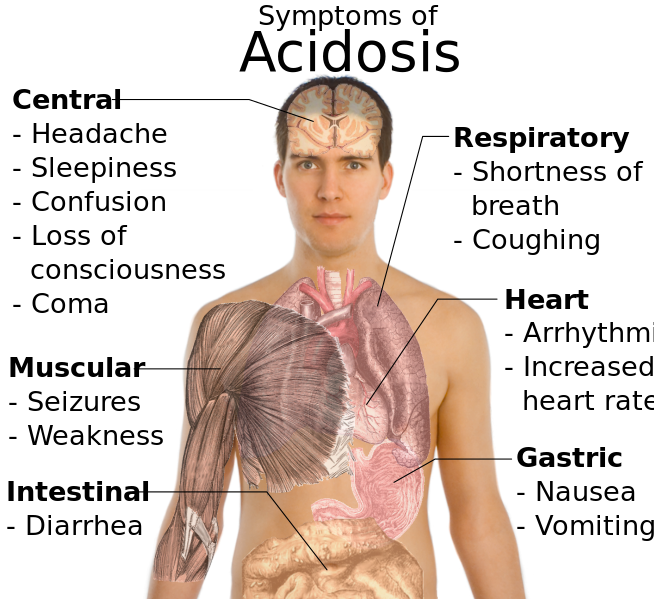
- ^ Answers.com Medical Encyclopedia: Metabolic Acidosis: Causes and symptoms By Altha Roberts Edgren. Retrieved on April 13, 2009
- ^ Symptoms mentioned in both metabolic and respiratory acidosis from the following two references:
– Wrongdiagnosis.com > Symptoms of Metabolic Acidosis Retrieved on April 13, 2009
– Wrongdiagnosis.com > Symptoms of Respiratory acidosis Retrieved on April 13, 2009 - ^ Medical Calculators > Calculated Bicarbonate & Base Excess teven Pon, MD, Weill Medical College of Cornell University