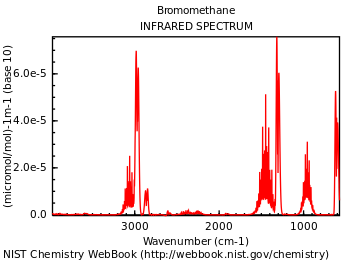
مطيافية الأشعة تحت الحمراء أو علم الأطياف ما تحت الحمراء (بالإنجليزية: Infrared spectroscopy): هو أحد فروع علم الأطياف الذي يتعامل مع المنطقة تحت الحمراء من الطيف الكهرومغناطيسي. ويشمل مجموعة من التقنيات، وأشهرها مطيافية الامتصاص (بالإنجليزية: Absorption spectroscopy). وتستعمل هذه المطيافية في تعيين العناصر الكيميائية في المركبات قيد الدراسة. وهي تستخدم بصفة رئيسية في علم الفلك لمعرفة عناصر المواد الموجودة في مناطق معينة من الكون ، كما لها استخدامات أخرى في نطاق التحليل الكيميائي. فبواسطة مطيافية الأشعة تحت الحمراء يمكم التعرف على ، مثلا الميثيلين والتفرقة بين الألكينات و المواد العضوية العطرية . ويمكن الاطلاع على جدول الارتباط لمطيافية الأشعة تحت الحمراء الذي يبين خصائص مواد عديدة يمكنها إصدار وامتصاص أشعة تحت الحمراء تميزها ، مثل بصمة الإصبع للإنسان.
ويدرس علم الأطياف ما تحت الحمراء تفاعل المادة نتيجة الأشعة تحت الحمراء. تستخدم الموجات الكهرومغناطيسية ذات طول الموجة بين الحدود المرئية للضوء وهي في حيز أطوال الموجة بين 800 نانومتر حتى أقصر الموجات الدقيقة حوالي 1 مليمتر (أنظر الشكل) .
النظرية
لكي يكون الجزيء فعال في مطيافية الأشعة تحت الحمراء ، بمعنى أن يكون له طيفاً في هذه المنطقة من أطوال الموجة ، يجب أن يمتلك الجزيء عزم ثنائي قطب. وعند تسليط الأشعة تحت الحمراء على الجزيء يحدث تداخل بين المجال الكهربائي للأشعة تحت الحمراء مع المجال الكهربائي المتولد عن عزم ثنائي قطب . وإذا توافق تردد المجال الكهربائي لشعاع من الأشعة تحت الحمراء مع تردد المجال في الجزيء ، فإن الجزيء يمتص هذا الشعاع .
عندئذ يحدث امتصاص الجزيء للطاقة ينقله من مستوى اهتزازي واطئ إلى مستوى اهتزازي أعلى. وعند فقدان الطاقة ورجوع الجزيء إلى مستوى اهتزازه “الأرضي” (ليس مثارا) يحصل انبعاث للضوء تحت الأحمر يمكن لكاشف حساس تسجيله . وتسجل تلك البيانات على جهاز يرسمها على ورق بياني تمثل صورة طيف الأشعة تحت الحمراء.
ويمكن حساب مقدار التردد الممتص من قبل الجزيئات أو المواد باستخدام القانون:
- ν = 1 2 π c k μ {\displaystyle \nu ={\frac {1}{2\pi c}}{\sqrt {\frac {k}{\mu }}}}
حيث:
ν {\displaystyle \nu } 
c: سرعة الضوء في الفراغ،
π: النسبة الثابتة،
K: ثابت يمثل قوة رابطة الجزيء،
μ: الكتلة المختزلة وتساوي:
- μ = m A m B m A + m B {\displaystyle \mu ={\frac {m_{A}m_{B}}{m_{A}+m_{B}}}}
يمكن للجزيء أن يهتز بأنماط مختلفة وكل نمط منها متعلق بطاقة مميزة . ويعتمد عدد أنماط الاهتزاز في جزيء على عدد N من الذرات المكونة له . فإن الجزيئات الخطية تمتلك 3N – 5 درجات من أنماط الاهتزاز؛ بينما تمتلك الجزيئات غير الخطية 3N – 6 درجات من أنماط الاهتزاز (وتسمى أيضاً درجات الحرية). فعلى سبيل المثال، فإن جزيء الماء H2O غير خطي ويمتلك 3= 6 – 3 × 3 درجات من أنماط الاهتزاز أو درجات الحرية.
تمتلك الجزيئات البسيطة ثنائية الذرات آصرة واحدة فقط، وحزمة اهتزاز واحدة أيضاً. فإذا كانت الجزيئة متناظرة كأن تكون N2 فإن طيفها لا يظهر في مطيافية الأشعة تحت الحمراء ولكنه يظهر في مطيافية رامان. أما الجزيئات غير المتناظرة مثل CO فإنها تظهر طيفاً في هذه المطيافية. أما الجزيئات التي تحتوي على أكثر من ذرتين فإنها تمتلك أطيافاً معقدة نظراً لوجود الكثير من الاهتزازات فيها، وهذا يعني أن الجزيئات الكبيرة لها قمم امتصاص متعددة في مطيافية الأشعة تحت الحمراء.
يمكن للذرات في مجموعة CH2 الشائعة في المركبات العضوية، أن تهتز بستة طرق مختلفة: مط متناظر وغير متناظر، انحناء مقصي، انحناء تأرجحي، انحناء التوائي، وانحناء ارتجاجي:
| اهتزاز متناظر | اهتزاز غير متناظر | اهتزاز مقصي |
|---|---|---|
 |
 |
 |
| اهتزاز تأرجحي | اهتزاز ارتجاجي | اهتزاز التوائي |
 |
 |
 |
يرمز للاهتزازات الامتطاطية بالرمز ν أما الاهتزازات الانحنائية فتأخذ الرمز δ.
وحدة القياس
اتفق الكيميائيون العاملون في نطاق مطيافية الأشعة تحت الحمراء على وحدة يستخدمونها في عملهم . فهم لا يستخدمون السنتيمتر مثلا أو وحدة أنجستروم للتعبير عن طول موجة الشعاع ، وإنما يستخدمون رقم الموجة ، وهي عدد الموجات في 1 سنتيمتر . فمثلا ، الميثيل له ترددات عند 1260/سنتيمتر ، و 1380/سم ، و 2870/سنتيمتر، والمواد العطرية لها ترددات عند 700/سم ، و 750/سم ، و860/سم و 900/سم ، وغيرها. [1]
طريقة فحص العينات
العينات الغازية
تستعمل خلية بشكل أنبوب أسطواني بطول 10 سم تحتوي على مرايا عاكسة ويكون الأنبوب ذو نوافذ شفافة للأشعة تحت الحمراء تصنع من أملاح بروميد البوتاسيوم و كلوريد الصوديوم ومجهز بمسالك لتفريغ الهواء أثناء القياس. ويمر الشعاع بقوة P0 وينفذ بقوة P ويسجل طيف الامتصاص.
العينات السائلة
يكون التركيز المناسب للقياس % 0.5 – 10 وزناً، ويوضع جزء قليل في خلية الامتصاص والتي سمكها b، ويجب أن يكون سمك الخلية قليلاً لأن ذلك سوف يعطي قمماً حادة ومتباعدة في مخطط الطيف، بنيما تؤدي زيادة سمك الخلية إلى زيادة الامتصاص وتكون قمم متعددة ومتداخلة وغير واضحة.
يمكن تخفيف العينات بمذيب مناسب مثل CCl4 و CHCl3 تستخدم مذيبات خالية من أواصر الهيدروجين التي تتداخل في 3300 cm−1 بينما يكون CCl4 شفافاً عند 1335 – 4000 ويكون CS2 شفافاً عند 625 – 1350.
كذلك لا يستخدم الماء كمذيب، كما لا تقاس العينات التي تحتوي على الماء لأنه يحتوي على أواصر الهيدروجين التي تسبب تداخلاً، إضافة إلى أن خلايا مطياف الأشعة تحت الحمراء مصنوعة من بلورات أملاح العناصر القلوية مثل NaCl و KBr و CsBr وليس الزجاج، وهذه الأملاح شديد التأثر بالماء ويجب أن تبقى جافة.
ولا تستخدم المذيبات القطبية مثل الكحولات في هذه المنطقة لأنها تمتص بقوة في منطقة الأشعة تحت الحمراء فضلاً عن تفاعلها مع هاليدات العناصر القلوية التي تصنع منها خلايا الامتصاص.
العينات الصلبة
يتم تهيئة العينات الصلبة بثلاث طرق هي:
طريقة القرص
يتم طحن 1-5 ملي غرام من العينة الصلبة مع 5 غرام من KBr أو CsBr في هاون عقيق، ويستعمل قرص شفاف (باستعمال مكبس) خالٍ من الأخداش ويوضع في المطياف للقياس.
طريقة العجينة
يتم مزج بضع ملي غرامات من العينة مع عشرة أمثالها من زيت هيدروكاربوني معدني مثل Nujel في هاون عقيق ويؤخذ قليل من الناتح ويوضع على إحدى صفيحتي القياس الملحية ثم توضع عليهما الصفيحة الأخرى.
طريقة الفلم
يتم تحضير فلم للمادة باستعمال مذيب متطاير لها على أقراص خلايا الامتصاص حيث يضاف المحلول قطرة فقطرة ويترك ليجف حتى يتكون فلم رقيق للمادة الصلبة ويقاس بعد ذلك في المطياف.
الاستخدامات والتطبيقات
تستخدم مطيافية الأشعة تحت الحمراء بشكل واسع في الأبحاث والصناعة كوسيلة بسيطة وموثوقة وفعالة للقياس، وضبط الجودة. فهي تستخدم بشكل خاص في التحليل الجنائي في القضايا المدنية وقضايا الجرائم، حيث تمكن من تعيين نوع البوليمر على سبيل المثال. وقد تعتبر أكثر الطرق استخدامًا في المطيافية التطبيقية.
أصبحت أدوات المطيافية الآن صغيرة، ويمكن نقلها، واستخدامها في التجارب الميدانية. ومع زيادة التقدم في مجال تقنية الحاسوب ومعالجة البيانات ، يمكن قياس العينات في المحاليل بدقة (إلا أن له امتصاص كبير للاشعة ، مما يجعل الأطياف غير مقروءة دون معالجتها باستخدام الحاسوب). بعض الأجهزة تعطينا تلقائيًا نوع المادة المقاسة من خلال مقارنتها مع آلاف الأطياف المرجعية المخزنة في ذاكرة الحاسوب.
يمكن قياس درجة التبلمر في صناعة البوليمر وذلك بقياس التغيرات في طبيعة أو كمية روابط معينة عند تردد معين مع مرور الزمن.
يمكن لأدوات البحث الحديثة قياس الأشعة تحت الحمراء لعينات تكون محل اهتمامنا بتكرار 32 مرة في الثانية. ويمكن أن يتم ذلك في وقت واحد أثناء القياس باستخدام تقنيات أخرى، وهذا يجعل من مراقبة التفاعلات الكيميائية والعمليات أسرع وأكثر دقة.
استخدمت مطيافية الأشعة تحت الحمراء بنجاح كبير في كل من الكيمياء العضوية وغير العضوية. كما استخدمت أيضًا بنجاح في مجال الالكترونيات الدقيقة لأشباه الموصلات[2]: وعلى سبيل المثال، يمكن تطبيق مطيافية الأشعة تحت الحمراء على أشباه الموصلات مثل السليكون ، و زرنيخيد غاليوم ثلاثي ، ونتريد غاليوم ثلاثي، وسيلينيد الزنك، والسليكون غير المتبلور، ونتريد السليكون، الخ.
التحليل النوعي
يوجد ارتباط وثيق بين قمم الامتصاص الاهتزاي وتركيب المجاميع الوظيفية المسؤولة عن هذا الامتصاص، ومنه يمكن الاستدلال على وجود هذه المجاميع في المركب حيث أن لكل من هذه المجاميع حزم امتصاص أو ترددات معينة تدل عليها ؛ ويتم تشخيص المركب العضوي بالاعتماد على منطقتين متميزتين في طيف المادة ، هما منطقة ترددات المجاميع ومنطقة ترددات العنصر النقي (بصمة الأصابع للعنصر).
منطقة المجاميع الفعالة
تقع عند الطول الموجي 2.5 – 8 مايكرومتر أي العدد الموجي cm−1 1450 – 4000 ويكون الامتصاص ناتجاً عن مجاميع تتكون من ذرتين فقط وليس امتصاص الجزيئة ككل. وهذه الاهتزازات تكون من النوع الامتطاطي وتستخدم للكشف عن هذه المجاميع، ويمكن أن يتأثر موقع المجموعة الواحدة في هذه المنطقة حسب موقع المجموعة أو المجاميع المجاورة لها وكذلك العوامل الفراغية.
منطقة طبع الأصابع
تقع عند الطول الموجي 15 – 8 مايكرومتر أي العدد الموجي 650 – 1500 cm−1 وهي اهتزازات انحنائية ويكون الامتصاص ناتجا عن اهتزاز الجزيء ككل، وتستخدم هذه المنطقة لإثبات نوع الجزيء أو المركب ً.
ملخص ذرى الامتصاص لروابط الجزيئات العضوية
 مقالة مفصلة: جدول الارتباط لمطيافية الأشعة تحت الحمراء
مقالة مفصلة: جدول الارتباط لمطيافية الأشعة تحت الحمراء
رقم الموجة (Wavenumber) مدرج في cm−1.
استخدامات في علم الفلك
 مقالة مفصلة: علم فلك الأشعة تحت الحمراء
مقالة مفصلة: علم فلك الأشعة تحت الحمراء
يمتص الغلاف الجوي للأرض وعلى الأخص بخار الماء في الهواء الأشعة تحت الحمراء ذات اطوال موجة أطول من 2 ميكرومتر بشدة تجعل القياس في تلك النطاقات أقل وضوحا . لهذا تصمم التلسكوبات الأرضية لقياس نطاقات الأشعة تحت الحمراء الأقصر من 2 ميكرومتر. الحل الأمثل هو إرسال التلسكوب كقمر صناعي في الفضاء حيث لا يوجد جو في الطبقات العليا ، وهناك يمكن تسجيل الأشعة تحت الحمراء في جميع نطاقاتها كاملة.
تصدر النجوم والمجرات أيضا أشعة تحت الحمراء . وتختلف نفاذية الأشعة الكهرومغناطيسية عند تخللها للغبار الكوني كثيرا بحسب طول موجة الأشعة . فتنخفض نفاذية طول موجة 2 ميكرومتر للاشعة تحت الحمراء القريبة (قريبة من الضوء الأحمر في طيف الضوء) إلى نحو 1/10 بمقارنتها بنفاذية الضوء المرئي . بذلك تصبح أجرام خلف سحابة الغبار مرئية ويمكن تصويرها ، مثل تصوير النجوم الناشئة ، وتصوير مركز المجرة وكذلك رصد حوصلة مجرة بعيدة تصدر أشعة تحت الحمراء.
في أكتوبر2011 أعلن علماء أن الغبار الكوني يحتوي مركبات عضوية أيضا ، بعضها ألفاتي وبعضها عطري ، تبلغ أحجام تلك المركبات نحو 1و0 ميكرومتر ، وهي قد تكون قد نشأت طبيعيا من النجوم.[3][4][5] أعلنت ناسا في فبراير 2014 عن تكوينها لقاعدة معلوماتية كبيرة ، تعتمد على مطيافية الاشعة تحت الحمراء ، بغرض البحث عن الهيدروكربونات العطرية PAHs في الكون. وطبقا لتقريرات المتخصصين في ناسا فربما يكون 20 % من الكربون في الكون مقترنا في هيدروكربونات عطرية متعددة الحلقات ، وربما كانت تلك هي البنة الأولى لنشأة الحياة. ويبدو أن هيدروكربونات عطرية تكونت بعد فترة من الانفجار العظيم وتوزعت في الكون ، كما أنها توجد في المرحل الأولى لتكون نجوم جديدة وفي كواكب خارج المجموعة الشمسية .[6]