رابط تحميل كتاب أساسيات الكمياء الضوئية:
https://exophy.blogspot.com/2017/05/exophy-exophy-pdf_3.html

الكيمياء الضوئية: الصورة الكاملة لتفاعلات الضوء والمادة
December 2020
Project: Photons and Metter interactions
Authors:
Ali Edriss
Sudan University of Science and Technology
معادلات علي يوسف تم اكتشافها منذ 2016 بعدما قرأت كتب عن الثيرمودايناميك والكيمياء الفيزيائية، ولاحظت ان تناول هذه الكتب في عنوان الكيمياء الضوئية ليس مكتمل وانما هنالك ابواب ناقصة فمثلا لماذا يتفاعل الضوء مع هذه المادة دون غيرها، والظواهر الضوئية التي تحدث بصورة طبيعية مثل الفلورة Fluorescence والفسفرة Phosphorescence و الأنبعاث الضوئي photoluminescence بالاضاقة الي الكهروضوئية Photoelectric وغيرها من التفاعلات التي يدخل فيها الضوء واهم مثال عليها هي الظواهر الضوئية غير الخطية للمواد Nonlinear Optics ، كل هذه الظواهر وجدت تفسيرات علمية لها وتطبيقات ولكن السؤال هل هنالك قانون واحد يجمعها؟ مهمة الفيزيائي حسب اعتقادي هي ان يرصد هذه الظواهر ثم جمعها في قانون فيزيائي واحد بحيث يسهل علينا التنبؤ بتصرفات هذه الظواهر في المستقبل مهما اختلفت الظروف. حقيقة كنت اظن من البداية ان قوانين الثيرمودايناميك يمكن ان تقودني الي هذه الفكرة لذا اعتكفت على دراستها حتى توصلت الي هذه المعادلات. ومما اكتشفته بعد ذلك ان معادلاتي والبالغ عددها اكثر من ثلاثين معادلة تستطيع تفسير اغلب الظواهر الضوئية في هذا الكون وذلك بسبب اندماجها وملائمتها الكاملة لقوانين الثيرمودايناميك، فقد ارتبطت بمفاهيم مثل الانثالبي والجهد الكيميائي وثابت الاتزان وغيرها من المفاهيم التي تعتبر قلب علم الديناميكا الحرارية. حتى التفاعلات الكيميائية المعقدة مثل تفاعلات الانزيمات وغيرها يمكن ان توصف بهذه المفاهيم. احدى النظريات المبشرة -امل ان تكون كذلك- منذ اكتشاف معادلات علي يوسف هي ان الضوء وخصوصا الليزر وجد طريقه في ان يحل مكان البترول والوقود الاحفري في توفير الطاقة للتصنيعات الكيميائية، وبالتالي يمكن توفير هذه المصادر كمواد خام تدخل في التصنيعات مباشر بدلا من أراقتها لتوفير الطاقة. كما امل ان علم الطاقة المتجددة سيأخذ مفاهيم اخرى خصوصا بعد ادخال علم الليزر عالي الطاقة والكثافة الي الثقافة العلمية وأرث المعرفة الانسانية. معادلات علي بمشيئة الله ستغير بعض المفاهيم عن الضوء وستكون دراسات الضوء عند التفاعلات الكيميائية والتي تغتبر عالم لوحدها وذلك للطريقة الغريبة التي يتصرفها الضوء عند التفاعلات . وكمثال لذلك انه يعتقد ان عمل الليزر عند تفاعله مع سطوح المواد هو فقط تكوين بلازما ودرجات حرارة عالية يفضي الي انصهار هذا السطح وعمل فجوة بداخله بسبب هذه الحرارة ولكن معادلات علي يوسف تستطيع الاضافة علي ذلك بأن الليزر يستطيع ان يحدث هذه الفجوة بواسطة تبخير جزيئات او ذرات هذا السطح اذا تم ضبط طاقة وكثافة هذا الليزر للتغلب على القوة الرابطة لذرات هذا السطح دون عمل بلازما امام هذا السطح. ايضا من المفاهيم التي قد تغيرها معادلات علي يوسف هو الفهم السائد بأن الضوء عموما يستطيع أبداء التفاعلات او أنهائها ، لكن الفهم الصحيح ان الضوء يستطيع ان يتحكم تحكما كاملا في قيادة اي تفاعل كيميائي وبذلك يمكن له ان يتحكم في 90% من تكلفة التصنيعات العالمية عموما و الكيميائية خصوصا. هذا اول كتاب لي باللغة العربية وسابع طبعة من سلسلة تفسير علاقات الضوء والمادة باستخدام معادلات علي يوسف ، هذه المعادلات التي اجتهدت فيها طيلة اربع سنوات في تطويرها وتفسيرها لتقدم امثل اداء في تفسير هذه العلاقة ، هذا الكتاب اسال الله ان يكون اضافة حقيقية الي المعرفة العربية. تنقسم محتويات هذا الكتاب الي ستة فصول، ينتاول الفصل الاول الاشتقاق او مصدر معادلات علي يوسف من القوانين الرئيسية وهي معادلة ارهينيوس ودالة موجة الضوء ومعادلة شرودينجر او الهاملتوليان ثم القوانين التي تحكم الكثافة الاشعاعية بمركبات الموجة مثل المجال الكهربائي والمغناطيسي. الفصل الثاني يقدم تعريفات اكثر عن حدود المعادلة الرئيسية وتفسير بعض سلوك المعادلة. الفصل الثالث يتحدث عن سلوك المعادلة في الواقع ، وبسبب ان الطبيعة لها قوانينها الخاصة وبالتالي ليس اي قانون يضعه الانسان ستقبله الطبيعة لان الانسان ليس من خلق الطبيعة لهذا مقارنة قوانينه وافتراضاته مع سلوك الطبيعة امر مهم جدا وضروري. الفصل الرابع يتحدث عن علاقة معادلة علي يوسف بمفاهيم الثيرمودايناميك مثل الانثالبي والطاقة الحرة والانتروبيا وثابت الاتزان الكيميائي، هذه المفاهيم هي المحرك الرئيسي لجميع التفاعلات الكيميائية في هذا الكون. ادخال هذه المعادلة في تلك المفاهيم اعطت المعادلة حجم اكبر وجعلها اكثر دقة وشمولية لوصف الظواهر الضوئية في الكون. الفصل الخامس عبارة عن مثال رياضي تقريبي قمت به لمقارنة النتيجة مع التجارب والابحاث العالمية والحمد لله تحصلت علي نتائج مرضية بالرغم من عدم دقتها وذلك لان المعادلة تحتوي على بعض الثوابت التي نحتاج الي تعيينها معمليا. الفصل السادس يتحدث عن مقارنة المعادلات مع بعض القوانين الكونية التي تم اكتشافها في مطلع القرن السابق مثل معادلة اينشتاين للظاهرة الكهروضوئية و تشتت ريلاي وقد تحصلت على نتائج مرضية بحيث استطاعت معادلاتي تفسير هذه القوانين والحمد لله. بعد ذلك تاتي الخاتمة ثم قائمة المراجع ولله الحمد والمنة. ختاما اتمنى لكم قراءة مفيدة لهذا الكتاب وامل ان يتلمس عندكم روح الابداع والاقدام لأنه في الحقيقة هذا الكتاب قد فتح بابا جديدا في مجال الفوتونات خصوصا يمكن ان يفضي الي تطبيقات كتيرة وعديدة ويضيف مفردات وافكار في جسم المعرفة الانسانية.



الكيمياء الضوئيه
الكيمياء الضوئية Photochemistry
الكيمياء الضوئية هي فرع من فروع علم الكيمياء، ويشمل دراسة التفاعلات بين كلا من الذرة، والجزيئات الصغيرة والضوء(أو الاشعاع الكهرومغناطيسى).مثله كمثل كل الفروع العلمية فأن الكيمياء الضوئية تستخدم النظام الدولي SI أو نظام القياس المتري. الوحدات المهمة والثوابت التي يتم استخدامها بكثرة تتضمن الأمتار(و أشكاله المختلفة مثل السنتيمتر، الميليمتر، الميكرومتر، النانومتر، وهكذا..) والثوانى، الهرتز، الجول، المول، ثابت الغاز R وثابت بولتزمان. وهذه الوحدات والثوابت متكاملة أيضا مع مجال كيمياء الطبيعة.
أول قانون للكيمياء الضوئية يعرف باسم قانون جروتاس ـ درابر (نسبة للكيميائيين C.J.T. de Grotthuss و John W. Draper)، والذي ينص على أنه يجب على الضوء أن يمتص من قبل مادة كيميائية ليحدث تفاعل كيميائي ضوئي.
وثاني قانون للكيمياء الضوئية، قانون ستارك ـ أينشتين، والذي ينص على أنه لكل فوتون ضوئي يتم امتصاصه من قبل نظام كيميائي، فقط ـ جزئ واحد فقط يتم تنشيطه لأجل تفاعل كيميائي ضوئي. وذلك القانون يعرف أيضا بقانون تساوى الضوء والذي قام باشتقاقه ألبرت أينشتين حينما كانت نظرية الكم(الفوتون) للضوء يتم تطويرها.
التفاعلات الكيميائية تحدث فقط عندما يكتسب الجزيء “طاقة التنشيط” اللازمة. وهناك مثال بسيط يمكن أن تكون احتراق من البنزين (أ الهيدروكربون) إلى ثاني أكسيد الكربون والماء. في هذا التفاعل، يتم توفير طاقة التنشيط في شكل حرارة أو شرارة. في حالة التفاعلات الضوئية الضوء يوفر طاقة التنشيط. ببساطة، الضوء هو آلية توفير الطاقة اللازمة لتفعيل العديد من التفاعلات. في حالة استخدام ضوء الليزر، فمن الممكن أن تثير انتقائيا الجزيء وذلك لإنتاج الحالة الإلكترونية اوالتذبذبية المطلوبة. بنفس القدر، قد يكون من الانبعاثات دولة معينة رصدها بشكل انتقائي، وتوفير قدر من سكان تلك الدولة. إذا كان النظام الكيميائية في الضغط المنخفض، وهذا يتيح للعلماء مراقبة توزيع الطاقة من المنتجات من تفاعل كيميائي قبل الاختلافات في الطاقة قد لطخت بها وبلغ متوسط بواسطة الاصطدامات المتكررة.
تطبيقات في مجال الكيمياء الضوئية
توجد العديد من العمليات التي تشتمل على تطبيقات كيميائية ضوئية. ففي البشر مثلا يُعتمد على الكيمياء الضوئية في إنتاج فيتامين دي. يمكن وصف التطبيق الكيميائي بأنه تفاعل كيميائي ناتج عن الضوء، بالإضافة إلى أن بعض التفاعلات تحتاتج إلى الحرارة لتتم.
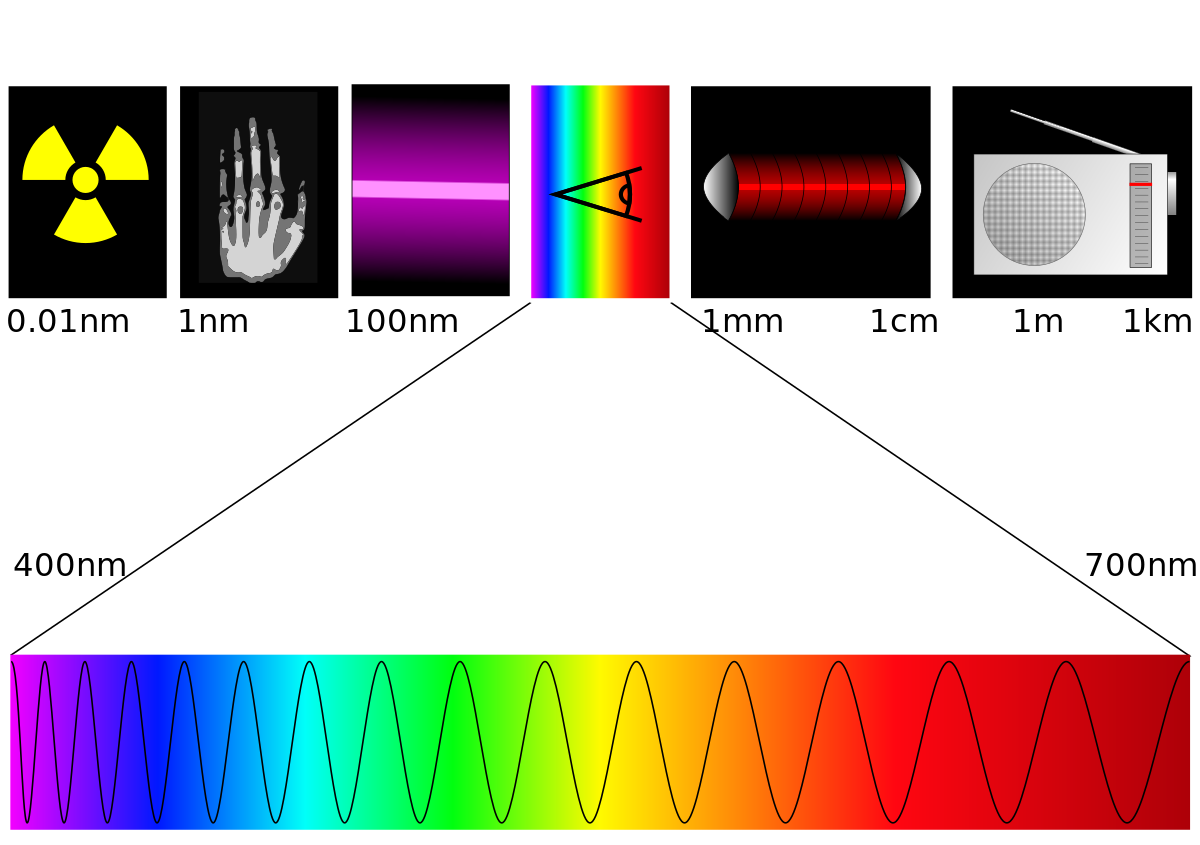
ترددات الاطياف الضوئية
الكيميائين الضوئيين عادة يعملون في أقسام قليلة فقط من [الطيف [الكهرومغناطيسية]]. بعض المقاطع الأكثر استخداما على نطاق واسع، وترددات موجاتها، هي التالية:
الأشعة فوق البنفسجية: 100-400 نانومتر
الضوء المرئي: 400-700 نانومتر
الأشعة تحت الحمراء القريبة: 700-2500 نانومتر
تاريخ:
على الرغم من وجود هذا النوع من الكيمياء من قديم الزمان، إلا أن أول وصف وملاحظة لأحد تطبيقاته لم يتم إلا في عام 1834 للميلاد،
الكيمياء الضوئية photochemistry
ملخص
فرع الكيمياء الذي يتعامل مع العمل الكيميائي للضوء
نظرة عامة
الكيمياء الضوئية هي فرع الكيمياء المعنية بالتأثيرات الكيميائية للضوء. بشكل عام ، يستخدم هذا المصطلح لوصف التفاعل الكيميائي الناجم عن امتصاص الأشعة فوق البنفسجية (الطول الموجي من 100 إلى 400 نانومتر) ، أو الضوء المرئي (400 – 750 نانومتر) أو الأشعة تحت الحمراء (750 – 2500 نانومتر).
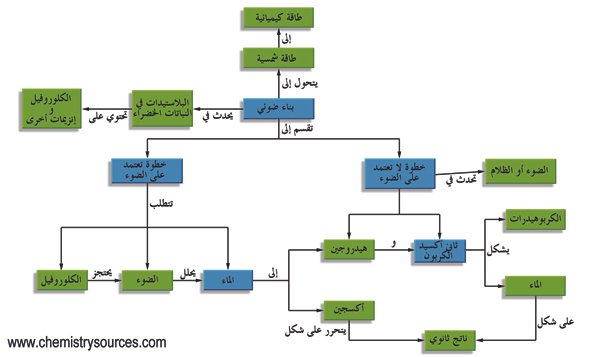
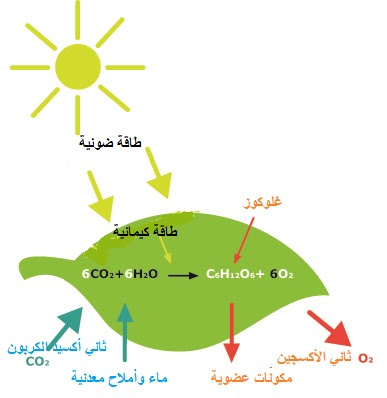
في الطبيعة ، تعد الكيمياء الضوئية ذات أهمية كبيرة لأنها أساس التمثيل الضوئي والرؤية وتكوين فيتامين (د) مع ضوء الشمس. تتفاعل التفاعلات الكيميائية الضوئية بشكل مختلف عن التفاعلات التي تعتمد على درجة الحرارة. تصل المسارات الكيميائية الضوئية إلى وسيط عالي الطاقة لا يمكن توليده حرارياً ، وبالتالي التغلب على حواجز التنشيط الكبيرة في فترة زمنية قصيرة ، والسماح بردود الفعل التي يتعذر الوصول إليها بعمليات حرارية. الكيمياء الضوئية مدمرة أيضًا ، كما يتضح من التحلل الضوئي للمواد البلاستيكية.
على حد سواء. قسم فيزيائي كيميائي يدرس التفاعل بين الطاقة الضوئية والتغير الكيميائي للمادة. بمعنى واسع ، يشمل أيضًا مناطق مثل الأشعة السينية والأشعة السينية ، ولكن عادة ما يتعامل مع الضوء المرئي ، والأشعة تحت الحمراء والمناطق فوق البنفسجية. قانون الكهف – درابر (فقط الضوء الذي يمتصه نظام المادة يعمل ضوئيًا ، أول قانون للكيمياء الضوئية) ، وقانون معادلة الكيمياء الضوئية (يتم امتصاص الضوء في وحدات الفوتونات ، وعدد الفوتونات الممتصة مساوٍ لعدد الجزيئات التي تخضع في البداية لتغيرات كيميائية ، بناءً على القانون الثاني للكيمياء الضوئية) وما شابه ذلك. الصورة الفوتوغرافية مهمة من ناحية التطبيق ، تكنولوجيا النسخ الأخرى ، حفاز ضوئي ، إلخ. آلية التمثيل الضوئي والقبول البصري مهمة في الكيمياء الحيوية. → التفاعل الكيميائي الضوئي
مصدر Encyclopedia Mypedia
أهداف المقرر:
يهدف هذا المقرر إلى أعطاء الطالب أسس الكيمياء الضوئية.
المحتوى العلمي للمقرر:
قواعد أساسية في الكيمياء الضوئية – قوانين الكيمياء الضوئية- قانون لامبرت وبير – الفلورسينية والفوسفورانسية – الأسس الطبيعية لليومنيسنز الجزيئى – التفاعلات الضوء كيميائية والنتاج الكمي – الطرق التجريبية في كيمياء الضوء – كيناتيكية التفاعلات الضوء كيميائية – التقنية والتطبيقات في كيمياء الضوء.
الكيمياء الضوئية
الكتب الأساسية:
§ Principles And Applications of PhotoChemistry, R. P. Wayne, 1988, Oxford.
المراجع العلمية المساندة:
§ PhotoChemistry; C. E. Wayne & R. P. Wayne, 1996, OUP primer.
§ Essentials of Molecular PhotoChemistry, A. Gilbert & J. Baggott.
§ Modern Molecular PhotoChemistry, 1991, University Science Books.

كيمياء ضوئية
من ويكيبيديا، الموسوعة الحرة
اذهب إلى التنقل
اذهب إلى البحث
الكيمياء الضوئية هي فرع من فروع علم الكيمياء، ويشمل دراسة التفاعلات بين كلا من الذرّة، والجزيئات الصغيرة والضوء(أو الإشعاع الكهرومغناطيسى).مثله كمثل كل الفروع العلمية فأن الكيمياء الضوئية تستخدم النظام الدولي SI أو نظام القياس المتري.
الوحدات المهمة والثوابت التي يتم استخدامها بكثرة تتضمن الأمتار(و أشكاله المختلفة مثل السنتيمتر، الميليمتر، الميكرومتر، النانومتر، وهكذا..) والثوانى، الهرتز، الجول، المول، ثابت الغاز R وثابت بولتزمان. وهذه الوحدات والثوابت متكاملة أيضا مع مجال كيمياء الطبيعة.
أول قانون للكيمياء الضوئية يعرف باسم قانون جروتاس ـ درابر (نسبة للكيميائيين C.J.T. de Grotthuss و John W. Draper)، والذي ينص على أنه يجب على الضوء أن يمتص من قبل مادة كيميائية ليحدث تفاعل كيميائي ضوئي.
وثاني قانون للكيمياء الضوئية، قانون ستارك ـ أينشتين، والذي ينص على أنه لكل فوتون ضوئي يتم امتصاصه من قبل نظام كيميائي، فقط ـ جزئ واحد فقط يتم تنشيطه لأجل تفاعل كيميائي ضوئي. وذلك القانون يعرف أيضا بقانون تساوى الضوء والذي قام باشتقاقه ألبرت أينشتين حينما كانت نظرية الكم(الفوتون) للضوء يتم تطويرها.
التفاعلات الكيميائية تحدث فقط عندما يكتسب الجزيء “طاقة التنشيط” اللازمة. وهناك مثال بسيط يمكن أن تكون احتراق من البنزين (أ الهيدروكربون) إلى ثاني أكسيد الكربون والماء. في هذا التفاعل، يتم توفير طاقة التنشيط في شكل حرارة أو شرارة. في حالة التفاعلات الضوئية الضوء يوفر طاقة التنشيط. ببساطة، الضوء هو آلية توفير الطاقة اللازمة لتفعيل العديد من التفاعلات. في حالة استخدام ضوء الليزر، فمن الممكن أن تثير انتقائيا الجزيء وذلك لإنتاج الحالة الإلكترونية اوالتذبذبية المطلوبة. بنفس القدر، قد يكون من الانبعاثات دولة معينة رصدها بشكل انتقائي، وتوفير قدر من سكان تلك الدولة. إذا كان النظام الكيميائية في الضغط المنخفض، وهذا يتيح للعلماء مراقبة توزيع الطاقة من المنتجات من تفاعل كيميائي قبل الاختلافات في الطاقة قد لطخت بها وبلغ متوسط بواسطة الاصطدامات المتكررة.
تطبيقات في مجال الكيمياء الضوئية
توجد العديد من العمليات التي تشتمل على تطبيقات كيميائية ضوئية. ففي البشر مثلا يُعتمد على الكيمياء الضوئية في إنتاج فيتامين دي. يمكن وصف التطبيق الكيميائي بأنه تفاعل كيميائي ناتج عن الضوء، بالإضافة إلى أن بعض التفاعلات تحتاتج إلى الحرارة لتتم.
ترددات الأطياف الضوئية
الكيميائين الضوئيين عادة يعملون في أقسام قليلة فقط من [الطيف [الكهرومغناطيسية]]. بعض المقاطع الأكثر استخداما على نطاق واسع، وترددات موجاتها، هي التالية:
- الأشعة فوق البنفسجية: 100-400 نانومتر
- الضوء المرئي: 400-700 نانومتر
- الأشعة تحت الحمراء القريبة: 700-2500 نانومتر
تاريخ
على الرغم من وجود هذا النوع من الكيمياء من قديم الزمان، إلا أن أول وصف وملاحظة لأحد تطبيقاته لم يتم إلا في عام 1834 للميلاد،
مراجع
Balzani, Vincenzo; Carassiti, Vittorio (1970). Photochemistry of Coordination Compounds. New York, New York: Academic Press, Inc. صفحات 37–39.
- Photochemistry, website of William Reusch (Michigan State University), accessed 26 June 2016 نسخة محفوظة 05 ديسمبر 2017 على موقع واي باك مشين.