تصنيف:كيماويات التصوير الضوئي
صفحات تصنيف «كيماويات التصوير الضوئي»
أ
- أزرق بروسيا
-
أزرق بروسيا
أزرق بروسيا
الاسم النظامي (IUPAC) Iron(II,III) hexacyanoferrate(II,III)
المعرفات رقم CAS 14038-43-8 
بوب كيم (PubChem) 2724251  [PubChem]
[PubChem]
الخواص صيغة كيميائية C18Fe7N18 كتلة مولية 859.23 غ.مول−1 المظهر Blue opaque crystals علم الأدوية طريق التناول Oral المخاطر صحيفة بيانات سلامة المادة MSDS prussian blue مركبات متعلقة كتيونات أخرى فيرو سيانيد البوتاسيوم
فيروسيانيد الصوديومفي حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) تعديل مصدري – تعديل 
أزرق بروسيا هو خضاب أزرق غامق صيغته الكيميائية Fe7(CN)18⋅14H2O.
ولهذا الخضاب أسماء أخرى هي أزرق برلين وفي الرسم الأزرق الباريسي (عاصمة فرنسا).
موجة الكاناجاوا العظيمة، يظهر في هذه اللوحة الاستخدام المكثف للأزرق البروسي.
- أسيتات السليولوز
- أسيتات الصوديوم
- أسيتانيليد
ب
- بروميد البوتاسيوم
-
بروميد البوتاسيوم
أسماء أخرى Potassium bromide
المعرفات CAS 7758-02-3 بوب كيم 253877
الخواص الصيغة الجزيئية KBr الكتلة المولية 119.01 غ/مول المظهر صلب أبيض الكثافة 2.75 غ/سم3 نقطة الانصهار 732 °س نقطة الغليان 1435 °س الذوبانية في الماء ينحل بشكل جيد جداً في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) تعديل مصدري – تعديل 
بروميد البوتاسيوم مركب كيميائي صيغته KBr، ويوجد في الشروط القياسية على شكل صلب بلوري أبيض.
التحضي
ريحضر المركب بعدة طرق منها التفاعل بين كربونات البوتاسيوم ومزيج من بروميد الحديد الثنائي والثلاثي Fe3Br8:
- 4 K 2 CO 3 + Fe 3 Br 8 ⟶ 8 KBr + Fe 3 O 4 + 4 CO 2 {\displaystyle {\ce {4K2CO3 + Fe3Br8 -> 8KBr + Fe3O4 + 4CO2}}}
الخواص
يوجد بروميد البوتاسيوم في الشروط القياسية على شكل بلورات بيضاء اللون، ذات انحلالية جيدة جداً في الماء.
يتفاعل بروميد البوتاسيوم مع نترات الفضة لتحضير راسب بروميد الفضة ذي الخواص الضوئية المميزة.
- KBr ( aq ) + AgNO 3 ( aq ) ⟶ AgBr ( s ) + KNO 3 ( aq ) {\displaystyle {\ce {KBr(aq) + AgNO3(aq) -> AgBr(s) + KNO3(aq)}}}
الاستخدامات
الطبية
يستخدم بروميد البوتاسيوم على نطاق واسع مضاداً للاختلاج ومهدئاً في أواخر القرن التاسع عشر وأوائل القرن العشرين، مع استخدام بدون وصفة طبية حتى عام 1975 في الولايات المتحدة.ويرجع ذلك إلى أيون بروميد (بروميد الصوديوم هو على قدم المساواة فعالة). يستخدم بروميد البوتاسيوم دواءاً بيطرياً، ومن ضمن مضادات للصرع للكلاب.
البصرية
يعد بروميد البوتاسيوم شفافاً في نطاق عريض نسبياً من الطيف الكهرومغناطيسي، وذلك من مجال الأشعة فوق البنفسجية القريب إلى مجال الأشعة تحت الحمراء، وليس لديه أي امتصاص يذكر؛ لذلك يستخدم في تركيب نوافذ أجهزة المطيافيات المختلفة
- بروميد الفضة
-
اذهب إلى التنقل اذهب إلى البحث
بروميد الفضة
أسماء أخرى bromargyrite
bromyrite
silver(I) bromideالمعرفات رقم CAS 7785-23-1 بوب كيم 66199
الخواص الصيغة الجزيئية AgBr الكتلة المولية 187.77 غ/مول المظهر صلب أصفر شاحب الكثافة 6.47 غ/سم3 نقطة الانصهار 430 °س نقطة الغليان 1502 °س الذوبانية في الماء غير منحل عملياً في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) تعديل مصدري – تعديل 
بروميد الفضة هو مركب كيميائي صيغته AgBr، ويوجد في الشروط القياسية على شكل صلب بلوري أصفر شاحب اللون.
الوفرة الطبيعية والتحضير
يوجد بروميد الفضة في الطبيعة على شكل معدن برومارجيريت.يمكن تحضير المركب مخبرياً من تفاعل ترسيب بعملية مزج نترات الفضة مع بروميد البوتاسيوم:
- A g N O 3 + K B r ⟶ A g B r ↓ + K N O 3 {\displaystyle \mathrm {AgNO_{3}+KBr\longrightarrow AgBr\downarrow +\ KNO_{3}} }
الخواص
يوجد بروميد الفضة في الشروط القياسية على شكل صلب بلوري له لون أصفر شاحب، حساس للضوء؛ وهو عملياً غير منحل في الماء (ينحل منه مجرد 0.14 ميليغرام في الليتر عند 25°س.)
الاستخدامات
نظراً للحساسية الضوئية لمركب بروميد الفضة لذلك استخدم في التصوير الفوتوغرافي منذ القرن التاسع عشر.
- بروميد الكادميوم
- بورات
- بورق
- بيرمنغنات البوتاسيوم
- بيروغالول
- بيروكبريتيت الصوديوم
- بيكبريتات الصوديوم
-
بيكبريتات الصوديوم
بيكبريتات الصوديوم
الاسم النظامي (IUPAC) كبريتات صوديوم هيدروجينية
أسماء أخرى بيكبريتات صوديوم
كبريتات صوديوم حامضية
كعكة النتر
المعرفات رقم CAS 7681-38-1 بوب كيم 516919
الخواص الصيغة الجزيئية NaHSO4 الكتلة المولية 120.06 غ/مول (شكل لامائي) 138.07 غ/مول (أحادي هيدرات) المظهر بلورات بيضاء الكثافة 2.742 غ/سم3 (لامائي) نقطة الانصهار 58.5 °س (أحادي هيدرات) >315 °س (لامائي ، يتفكك) نقطة الغليان يتفكك إلى Na2S2O7 الذوبانية في الماء 100 غ/100 مل عند 100°س المخاطر ترميز المخاطر توصيف المخاطر تحذيرات وقائية في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) بيكبريتات الصوديوم ويدعى أيضاً بـكبريتات الصوديوم الحامضية هو مركب كيميائي له الصيغة NaHSO4. له أيضاً الاسم الشائع كعكة النتر (niter cake) لأنه كان يصنع بطريقة قديمة غير مستخدمة حالياً وذلك بتفاعل نترات الصوديوم مع حمض الكبريت.
التحضير
تحضر بيكبريتات الصودوم حالياً بإحدى طريقتين، الأولى تتضمن مزج كميات ستوكيومترية من هدروكسيد الصوديوم مع وحمض الكبريت حسب التفاعل التالي:
NaOH + H2SO4 → NaHSO4 + H2Oكما يمكن أن يحضر من تفاعل كلوريد الصوديوم مع حمض الكبريت
NaCl + H2SO4 → NaHSO4 + HClالاستخدامات
- مستحضرات التنظيف المنزلية
- كشط المعادن في الصناعات المعدنية
- له تطبيقات ثانوية في خفض القلوية
بيكبريتات الصوديومالمراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/516919 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Sodium hydrogen sulfate — الرخصة: محتوى حر
shreve´s chemical process industries, fifth edition, ISBN 0-07-057147-
- بيكبريتيت الصوديوم
ث
ف
- فريسيانيد البوتاسيوم
-
فريسيانيد البوتاسيوم
فريسيانيد البوتاسيوم
Potassium ferricyanide
الاسم النظامي (IUPAC) Potassium hexacyanoferrate(III)
أسماء أخرى Red prussiate of Potash,
Prussian red,
Potassium ferricyanideالمعرفات رقم CAS 13746-66-2 
بوب كيم (PubChem) 26250
الخواص الصيغة الجزيئية K3[Fe(CN)6] الكتلة المولية 329.24 g/mol المظهر بلورات حمراء غامقة اللون، أحيانا على شكل حبيبات صغيرة، مسحوق برتقالي إلى أحمر غامق الكثافة 1.89 g/cm3، صلب نقطة الانصهار 300 °س، 573 °ك، 572 °ف نقطة الغليان يتحلل الذوبانية في الماء 330 g/L (“ماء بارد”)
464 g/L (20 °C)
775 g/L (“ماء ساخن”)الذوبانية قليل الذوبان في الكحول
ذائب في الحمض
ذائب في الماءقابلية مغناطيسية +2290.0·10−6 cm3/mol البنية البنية البلورية احادي الميل التنسيق الهندسي ثماني السطوح مع الحديد المخاطر توصيف المخاطر تحذيرات وقائية نقطة الوميض لا يحترق مركبات متعلقة أنيونات أخرى فيروسيانيد البوتاسيوم كتيونات أخرى أزرق بروسيا في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) فريسيانيد البوتاسيوم أو البروسايت الأحمر هو مركب كيميائي يحمل الصيغة K3[Fe(CN)6].
يحتوي هذا الملح الأحمر المتألق على أيون [Fe(CN)6]3− متناسق ثماني السطوح.
المركب ذائب في الماء ومحلوله يظهر تألقا ذي لون أصفر مخضر.
- فوسفات ثلاثي الصوديوم
- فوق أكسيد الصوديوم
ك
- كاتيكول
- كبريتات الصوديوم
-
كبريتات الصوديوم
كبريتات الصوديوم
الاسم النظامي (IUPAC) كبريتات صوديوم
أسماء أخرى ملح غلاوبر
كعكة الملحالمعرفات رقم CAS 7757-82-6 بوب كيم 24436
الخواص الصيغة الجزيئية Na2SO4 الكتلة المولية 142.06 غ/مول (لامائي) 320.20 غ/مول (مع عشر جزيئات ماء-عشاري هيدرات) المظهر مسحوق بلوري أبيض الكثافة 2.66 غ/سم3 (لامائي) 1.46 غ/سم3 (عشاري هيدرات) نقطة الانصهار 884 °س (لامائي) الذوبانية في الماء 30 غ/100 مل ماء عند 20 °س50 غ/100 مل ماء عند 33 °س (أعظمية) (بدرجات حرارة أعلى تتناقص انحلالية هذا المركب)
المخاطر توصيف المخاطر لا يوجدتحذيرات وقائية لا يوجدفي حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) كبريتات الصوديوم وهو مركب كيميائي له الصيغة Na2SO4، وهو الملح الصوديومي لحمض الكبريت. يمكن أن يتواجد بشكل لامائي ويدعى الشكل الخام منه أثناء إنتاجه بـكعكة الملح، أو متسانداً مع عشرة جزيئات ماء Na2SO4.10H2O ويدعى في هذه الحالة ملح غلاوبر. يتم الحصول على هذا الملح تقريباً بشكل متساوي إما من مصادر طبيعية أو من مصادر صناعية من المنتجات الثانوية لصناعة الرايون، الليثيوم، حمض كلور الماء ومركبات الكروم.
التحضير
من أهم المصادر الصناعية لكبريتات الصوديوم هي النواتج الثانوية لصناعة مركبات الكروم. تتم مفاعلة حمض الكبريت مع كلوريد الصوديوم حسب عملية مانهايم، حيث يتشكل في البداية بيكبريتات الصوديوم ومن ثم الملح المطلوب وذلك حسب المعادلات التالية:
NaCl + H2SO4 → NaHSO4 + HClNaCl + NaHSO4 → Na2SO4 + HClالعملية تجرى بشكل متقطع (Batch process).
توجد طريقة أخرى لتحضير هذا الملح بدرجة أعلى وذلك حسب طريقة هاريغريفز :
4NaCl + 2SO2 + 2H2O + O2 → 2Na2SO4 + 4HClكذالك قياس درجة الاس الهيدروجيني لمحلول مركز من كبريتات الصوديوم PH=7
تحضير ملح غلاوبر
يحضر ملح غلاوبر Na2SO4.10H2O وذلك بحل كعكة الملح بالمحلول الأم (mother liquor) وبإزالة الشوائب والتصفية ثم إعادة البلورة. يعالج المحلول بالكلس وأملاحه لتعديل الوسط، وبعد إزالة الشوائب الراسبة من أملاح الحديد، المغنيزيوم، والكالسيوم يمرر المحلول إلى مبلورات حيث يتم الحصول على البلورات بعد إجراء عملية التثفيل.
الاستخدامات
- الاستهلاك الأعظمي من ملح كبريتات الصوديوم يكون في صناعة عجينة الورق (kraft pulp).
- يستخدم في صناعة المنظفات المنزلية.
- يستخدم في صناعة الزجاج وذلك لإزالة فقاعات الهواء الصغيرة من الزجاج المصهور.
- يستخدم في الصناعات النسيجية حيث يضاف أثناء الصباغة لتقليل الشحن السالبة على الألياف مما يسهل من انتشار الصباغ بشكل متساوي.
- يستخدم أيضاً في معالجة المياه وذلك يتمثل في إزالة الكلور وطرد الغازات.
- كبريتيت الصوديوم
- كبريتيد الصوديوم
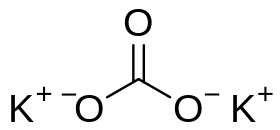
- كربونات البوتاسيوم
-
كربونات البوتاسيوم
كربونات البوتاسيوم
الاسم النظامي (IUPAC) كربونات البوتاسيوم
أسماء أخرى pearl ash
رماد بوتاسالمعرفات رقم CAS 584-08-7 بوب كيم 11430
الخواص الصيغة الجزيئية K2CO3 الكتلة المولية 138.2055 غ/مول المظهر صلب أبيض رطب الكثافة 2.29 غ/سم3 صلب نقطة الانصهار 891 °م الذوبانية في الماء 112 غ/100 مل (20°م) في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) كربونات البوتاسيوم هو مركب كيميائي صيغته K2CO3، ويوجد على شكل صلب أبيض اللون.
التحضير
يحضر كربونات البوتاسيوم تجاريًا بالتحليل الكهربائي لكلوريد البوتاسيوم؛ حيث يعرّض هيدروكسيد البوتاسيوم الناتج إلى غاز ثنائي أكسيد الكربون للحصول على هذا المركب:
- 2 K O H + C O 2 ⇌ K 2 C O 3 + H 2 O {\displaystyle \mathrm {\ 2KOH+CO_{2}\ \rightleftharpoons \ K_{2}CO_{3}+H_{2}O} }
الخواص
يوجد المركب في الشروط القياسية على شكل صلب أبيضا اللون ومتميع، وهو ذوّاب في الماء (غير ذواب في الكحول)، ويشكل محلول قلوي قوي في الأوساط المائية.
الاستخدامات
تستخدم كربونات البوتاسيوم في عدة صناعات منها صناعة الصابون والزجاج.
- كربونات الصوديوم
-
كربونات الصوديوم
كربونات الصوديوم
الاسم النظامي (IUPAC) كربونات الصوديوم
أسماء أخرى رماد الصودا
صودا الغسيلالمعرفات رقم CAS 497-19-8 بوب كيم 10340
الخواص الصيغة الجزيئية Na2CO3 الكتلة المولية 106.00 غ/مول المظهر بلورات بيضاء الكثافة 2.53 غ/سم3 نقطة الانصهار 851 °س نقطة الغليان يتفكك الذوبانية في الماء 50 غ/100 مل ماء عند 20 °س حموضة (pKa) 10.33 المخاطر ترميز المخاطر توصيف المخاطر تحذيرات وقائية في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) كربونات الصوديوم(أيضا) هو مركب كيميائي له الصيغة Na2CO3، ويدعى أيضاً بالاسم الشائع رماد الصودا أو صودا الغسيل، يتواجد بالشكل العادي على شكل بودرة بيضاء، محاليله في الماء قلوية. يمكن أن يوجد طبيعياً كمعدن أو صناعياً ويتم ذلك حالياً من خلال عملية سولفاي.
التحضير
طريقة لوبلان
كان رماد الصودا يحضر قديماً وفق عملية لوبلان وذلك نسبة إلى الكيميائي الفرنسي نيكولا لوبلان، لكنها حالياً غير مستخدمة. الطريقة تقسم إلى مرحلنين رئيسيتين
- تحضير كعكة الملح
وذلك بغلي كلوريد الصوديوم في حمض الكبريت فينطلق غاز كلوريد الهيدروجين مع تشكل كبريتات الصوديوم
2NaCl + H2SO4 → Na2SO4 + 2HCl- اختزال كعكة الملح
ويتم ذلك بمزج كبريتات الصوديوم الناتجة مع الكربون (الفحم) والحجر الكلسي
Na2SO4 + CaCO3 + 2C → Na2CO3 + 2CO2 + CaSالناتج كان يستحصل بغسل مستمر بالماء لإذابته وبالتالي فصله عن الرماد المتشكل (leaching)، ثم بالبلورة.
طريقة سولفاي
كربونات الصوديومعملية سولفاي وهي تنسب إلى الكيميائي البلجيكي إرنست سولفاي. تعتمد على المواد الأولية التالية: كربونات الكالسيوم، كلوريد الصوديوم، والأمونيا. لذلك تدعى أيضاً بطريقة أمونيا-صودا. تتمحور العملية تقنياً حول برج مجوف. في الأسفل يسخن الحجر الكلسي محرراً غاز ثاني أكسيد الكربون
CaCO3 → CaO + CO2يقرقر غاز ثاني أكسيد الكربون الناتج بمحلول مركز من كلوريد الصوديوم والأمونيا فيترسب لدينا بيكربونات الصوديوم
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Clتسخن بيكربونات الصوديوم الناتجة فنحصل على كربونات الصوديوم
2NaHCO3 → Na2CO3 + H2O + CO2أثناء ذلك يتم استرجاع الأمونيا من محلول كلوريد الأمونيوم بمعالجته مع هيدروكسيد الكالسيوم (الكلس المطفأ)، الناتج من معالجة أكسيد الكالسيوم (الكلس الحي) بالماء.
CaO + H2O → Ca(OH)2Ca(OH)2 + 2NH4Cl → CaCl2 + 2NH3 + 2H2Oكما يمكن تحضير كربونات الصوديوم بالتفاعل كربونات الامونيوم مع هيدروكسيد الصوديوم المركز NaOH+ (NH4)2CO3 → NH3+Na2Co3+H20
او من تشبيع محلول هيدروكسيد الصوديوم بالغاز ثاني اكسيد الكربون
الاستخدامات
- الاستخدام الرئيسي له في صناعة الزجاج.
- يدخل في صناعة الصابون والمنظفات المنزلية.
- يستخدم في صناعة عجينة الورق.
- كما يدخل في مجال معالجة مياه المجاري.
- يستخدم ايضاً في محلول تخدير الأسنان لتخفيف الشعور بالألم.
- له استخدام في الطب البيطري كمطهر للسطوح الملوثة.
- كرومات الفضة
- كلوريد الذهب الثلاثي
- كلوريد الزئبق الثنائي
- كلوريد الفضة
-
كلوريد الفضة
كلوريد الفضة
الاسم النظامي (IUPAC) Silver(I) chloride
أسماء أخرى cerargyrite
كلورارجيريت
horn silverالمعرفات رقم CAS 7783-90-6 
بوب كيم (PubChem) 24561
الخواص صيغة كيميائية AgCl كتلة مولية 143.32 غ.مول−1 المظهر White Solid الكثافة 5.56 g cm−3 نقطة الانصهار 455 °س، 728 °ك، 851 °ف نقطة الغليان 1547 °س، 1820 °ك، 2817 °ف الذوبانية في الماء 520 μg/100 g at 50 °C الذوبانية soluble in أمونياك, conc. حمض الهيدروكلوريك, conc. حمض الكبريتيك, alkali سيانيد, كربونات الأمونيوم, KBr, ثيوكبريتات الصوديوم;
insoluble in كحول, dilute حمضs.معامل الانكسار (nD) 2.071 البنية البنية البلورية كلوريد الصوديوم كيمياء حرارية الحرارة القياسية للتكوين ΔfH o298−127 kJ·mol−1 إنتروبيا مولية قياسية S o29896 J·mol−1·K−1 المخاطر صحيفة بيانات سلامة المادة Salt Lake Metals NFPA 704 مركبات متعلقة أنيونات أخرى فلوريد الفضة الأحادي, بروميد الفضة, يوديد الفضة في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) كلوريد الفضة هو مركب كيميائي له الصيغة الكيميائية AgCl؛ ويوجد في الشروط القياسية على شكل صلب بلوري أبيض اللون. يوجد المركب على شكل معدن في الطبيعة اسمه كلورارجيريت.
التحضير
ويتم تصنيع كلوريد الفضة بسهولة عن طريق المزج بين المحاليل المائية من نترات الفضة وكلوريد الصوديوم.
- AgNO 3 + NaCl ⟶ AgCl ↓ + NaNO 3 {\displaystyle {\ce {AgNO3 + NaCl -> AgCl(v) + NaNO3}}}
الخواص
يوجد المركب في الشروط القياسية على شكل بلورات بيضاء اللون؛ ولا ينحل المركب عملياً في الماء.
ينحل راسب كلوريد الفضة عند إضافة محاليل حاوية على ربيطات مثل الكلوريد أو السيانيد أو ثلاثي فينيل الفوسفين أو ثيوكبريتات أو ثيوسيانات أو الأمونيا.
- AgCl ( s ) + Cl − ( aq ) ⟶ AgCl 2 − ( aq ) {\displaystyle {\ce {AgCl (s) + Cl^- (aq) -> AgCl2^- (aq)}}}
- AgCl ( s ) + 2 S 2 O 3 2 − ( aq ) ⟶ ( Ag ( S 2 O 3 ) 2 ) 3 − ( aq ) + Cl − ( aq ) {\displaystyle {\ce {AgCl (s) + 2 S2O3^2- (aq) ->(Ag(S2O3)2)^3- (aq) + Cl^- (aq)}}}
- AgCl ( s ) + 2 NH 3 ( aq ) ⟶ Ag ( NH 3 ) 2 + ( aq ) + Cl − ( aq ) {\displaystyle {\ce {AgCl (s) + 2 NH3(aq) -> Ag(NH3)2+ (aq) + Cl^- (aq)}}}
لكلوريد الفضة حساسية للضوء؛ إذ يسود لونه ويتفكك عند التعرض للضوء.
الاستخدمات
يعد قطب كلوريد الفضة من الأقطاب المعيارية في الكيمياء الكهربائية.
- كولوديون
م
- ماء النار
- مادة الهالون
- مظهر (تصوير)
-
مظهر (تصوير)
المُظهِر
أو المادة المُظهرة هي مادة كيماوية تستخدم في التصوير التقليدي، ولها تطبيقات أيضا في الصناعات الدقيقة، حيث تُستعمل مواد بطريقة مشابهة لصناعة الشرائح الإلكترونية مثلا.
- ميتابيكبريتيت البوتاسيوم
ه
- هاليد الفضة
-
هاليد الفضة
هاليد الفضة وهو اسم عام يطلق على المركبات الناتجة من ارتباط الفضة مع أحد الهالوجينات
.هاليدات الفضة هي كلوريد الفضة (AgCl) وبروميد الفضة (AgBr) ويوديد الفضة (AgI)، بالإضافة فلوريد الفضة. يرمز غالباً لهاليدات الفضة بالرمز AgX.
الخواص
يكون للفضة في مركبات هاليدات الفضة غالباً رقم الأكسدة +1، إلا أن رقم الأكسدة +2 يمكن أن يلاحظ أحياناً، كما في مركب فلوريد الفضة الثنائية، والذي يعد الهاليد الوحيد الثابت من هاليدات الفضة الثنائية. لأغلب هاليدات الفضة انحلالية ضعيفة في الماء،
تتميز هاليدات الفضة بحساسيتها للضوء، لذلك تستعمل في مجال الأفلام الفوتوغرافية.
التحضير
تحضر مركبات هاليدات الفضة على العموم من تفاعل نترات الفضة مع أملاح الهاليدات المختلفة فتترسب هاليدات الفضة من المحلول.
الاستعمالات
تستعمل بشكل أساسي في مجال التصوير
من خلال طرق معقدة يمكن الحصول على بلورات في مختلف الأحجام والأشكال حسب حساسية الفيلم المراد الحصول عليه، حيث أن حساسية الفيلم تعلق بحجم البلورات المكونة لحبيبات الفيلم.
يتم إضافة جزيئات عضوية spectral sensitizers كطبقة إضافية على الحبيبات لتعزيز حساسية الحبيبات للضوء وبالأخص الألوان الأساسية الأحمر والأخضر والأزرق. فتقوم هذه الطبقة بامتصاص طاقة الضوء الأزرق أو الأحمر أو الأخضر وتحولها إلى بلورات هاليدات الفضة على شكل إلكترونات.
- هيدروكسيد الأمونيوم
- هيدروكسيد البوتاسيوم
- هيدروكسيد الصوديوم
- هيدروكسيلامين
- هيدروكينون
-
هيدروكينون
هيدروكينون
الاسم النظامي (IUPAC) Benzene-1,4-diol
أسماء أخرى Hydroquinone
Idrochinone
Quinol/1-4 dihydroxy benzene/1-4 hydroxy benzeneالمعرفات رقم CAS 123-31-9 
بوب كيم 785
الخواص صيغة كيميائية C6H6O2 كتلة مولية 110.11 غ.مول−1 المظهر white solid الكثافة 1.3 g cm−3, solid نقطة الانصهار 172 °س، 445 °ك، 342 °ف نقطة الغليان 287 °س، 560 °ك، 549 °ف الذوبانية في الماء 5.9 g/100 mL (15 °C) ضغط البخار 0.00001 mmHg (20 °C) البنية عزم جزيئي ثنائي القطب 1.4 D كود ATC D11 المخاطر ترميز المخاطر توصيف المخاطر تحذيرات وقائية NFPA 704 حد التعرض المسموح به U.S TWA 2 mg/m3 LD50 490 mg/kg (mammal, oral)
245 mg/kg (mouse, oral)
200 mg/kg (rabbit, oral)
320 mg/kg (rat, oral)
550 mg/kg (guinea pig, oral)
200 mg/kg (dog, oral)
70 mg/kg (cat, oral)في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) الهيدروكوينون
أو الهيدروكينون أيضا البنزين-1،4-ديول أو كينول، هو مركب عضوي عطري و نوع من الفينول، وهو مشتق من البنزين، وصيغته الكيميائية C6H4(OH)2. التركيب الكيميائي له، كما هو موضح في الجدول على اليمين، يضم مجموعتين من الهيدروكسيل المربوطين بحلقة بنزين في موقع البارا (ثنائي هيدروكسي البنزين). وهو أبيض ذو حبيبات صلبة. المشتقات من هذا المركب ايضا تسمى الهيدروكينونات. وقد صاغ فريدريك وولر اسم “الهيدروكوينون” في 1843.
الإنتاج
يتم إنتاج الهيدروكوينون صناعيا باستخدام طريقتين رئيسيتين:
- الطريق الأكثر استخداما على نطاق واسع يشبه عملية تصنيع الكيومين ، وينطوي على ألكلة البنزين مع البروبين ليعطي 1,4- ثنائي آيزوبروبيل بنزين، المركب الناتج يتفاعل مع الهواء لإعطاء بيس(هيدروبيروكسيد) وهو يشبه تركيب مركب هيدروبيروكسيد الكيومين ، المركب الناتج يتشكل لينتج عنه الأسيتون والهيدروكينون في الحمض.
- والطريق الثاني ينطوي على إضافة هيدروكسيل إلى الفينول وينطوي على استخدام الهيدروجين بيروكسايد ليعطي خليط من الهيدروكوينون والكاتيكول:
- C6H5OH + H2O2 → C6H4(OH)2 + H2O
هناك أساليب أخرى أقل شيوعا منها:
- تم اقتراح إمكانية اصطناع الهيدروكينون من الأسيتيلين وخماسي كربونيل الحديد
وقد انتج الهيدروكوينون لأول مرة في عام 1820 من قبل الكيميائيين الفرنسيين بليتير وكافينتو عن طريق التقطير الجاف لحمض الكوينيك.
الاستخدامات
الهيدروكوينون لديه مجموعة متنوعة من الاستخدامات المرتبطة أساسا مع عمله كعامل مختزل قابل للذوبان في الماء. وهو المكون الرئيسي في تحميض الأفلام والأوراق الفوتوغرافية بالأبيض والأسود، حيث مع مادة Metol، فإنه يختزل هاليدات الفضة إلى عنصر الفضة. هناك العديد من الاستخدامات الأخرى المرتبطة بقدرته على الاختزال. كمانع للبلمرة، الهيدروكوينون يمنع بلمرة حمض الأكريليك، ميتاكريليت الميثيل، سيانوأكريلات، ووحدات مبلمر أخرى و التي هي عرضة للبلمرة بسبب الجذور الحرة. هذا التطبيق يستغل خاصية الهيدروكوينون كمضاد للأكسدة. الهيدروكوينون يمكن أن يخضع لأكسدة خفيفة ليتحول إلى بارابنزوكوينون، C6H4O2، وغالبا ما تسمى كوينون. يمكن اختزال هذا التفاعل واعادته إلى الهيدروكوينون. بعض المركبات الكيميائية الحيوية في الطبيعة تحتوي على جزء الهيدروكوينون او الكوينون في تركيبها الكيميائي مثل مرافق الإنزيم Q10.
تقليل تصبغ الجلد
في الطب البشري، يتم استخدام الهيدروكوينون كتطبيق موضعي في تفتيح البشرة للحد من زيادة التلون في البشرة و معالجة مشاكل التصبغات الجلدية. هذا الاستخدام في مستحضرات التجميل تم منعه في عدد من الدول بما في ذلك الدول الأعضاء في الاتحاد الأوروبي في إطار التوجيه 76/768 / EEC: 1976. في عام 2006، ألغت إدارة الغذاء والدواء الأمريكية الموافقة السابقة من الهيدروكوينون، وتم حظر استخدامه في كل الأدوية بدون وصفة طبية وذكرت إدارة الاغذية والادوية الأمريكية ان الهيدروكوينون لا يمكن استبعاد كونه مادة مسرطنة محتملة. وهذا الاستنتاج الذي توصل إليه استنادا إلى مدى امتصاصه من الجلد في البشر و فرصة حدوث الأورام في الفئران في العديد من الدراسات على الفئران والتي اوضحت زيادة معدلات الأورام، بما في ذلك فرط تنسج خلايا تجويفات الغدة الدرقية، تفاوت النوى (الاختلاف في أحجام النوى)، سرطان الدم، والأورام الكبدية وأورام في الكلى. وقد أبرزت الحملة من أجل امان و سلامة مستحضرات تجميل أيضا المخاوف من الهيدروكوينون. وقد كشفت دراسات عديدة أن الهيدروكوينون يمكن أن يسبب تمغرا خارجي المنشأ وهو مرض تشوهات على الجلد ايحصل فيه ترسيب أصباغ ذات لون الأزرق والأسود على الجلد.
استخدامات الهيدروكينون كمعالج لمشاكل زيادة تلون البشرة يمكن أن تكون فعالة مع الاستخدام السليم ولكن يمكن أيضا أن يسبب حساسية الجلد. يجب استخدام واقي من الشمس يوميا و عدم استخدامه لفترات طويلة أكثر من 4 أشهر. في الولايات المتحدة، تحتوي العلاجات الموضعية 2٪ هيدروكوينون. خلافا لذلك، التراكيز الأعلى (تصل إلى 4٪) يجب الحد منها واستخدامها بحذر.
تواجده في الطبيعية
الهيدروكوينونات واحدة من اثنين من المواد المتواجدة في الغدد الدفاعية للخنافس البومباردييه، جنبا إلى جنب مع بيروكسيد الهيدروجين (ومركبات ربما غيرها، اعتمادا على الأنواع) والذي يتجمع في خزان. يفتح الخزان من خلال صمام من العضلات إلى خزان اخر سميك الجدران يحتوي على خلايا تفرز انزيم الكتالاز والبروكسيداز والتي عند إفرازها تقوم بتكسير الهيدروجين بيروكسيد و تسريع اكسدة الهيدروكوينون إلى باراكوينون. هذه التفاعلات تنتج الأكسجين الحر وتولد حرارة كافية لايصال درجة حرارة المزيج إلى نقطة الغليان وتبخير نحو خمس كميته، مما ينتج عنه رذاذ حار من بطن الخنفساء. مشتقات فارنيسيل الهيدروكينون هي المهيجات الرئيسية التي يتم افرازها من نوع من انواع النباتات كشجيرة كلب البودل (بالإنجليزية: poodle-dog bush) وتسبب اكزيما وتهيجا جلديا شديدا. ويعتقد ان الهيدروكوينون هو المادة السامة في الفطر أجاريكوس Agarisuc hondensis و تبين ان الهيدروكينون من المكونات الكيميائية للمادة الطبيعية العكبر. كما أنها واحدة من المركبات الكيميائية الموجودة في castoreum. ويتم جمع هذا لمركب من الحويصلات القندس beaver castor scas.
ي
- يوديد البوتاسيوم
-
يوديد البوتاسيوم
اذهب إلى التنقل اذهب إلى البحث
يوديد البوتاسيوم
الاسم النظامي (IUPAC) يوديد البوتاسيوم
المعرفات رقم CAS 7681-11-0 بوب كيم 4875
الخواص الصيغة الجزيئية KI الكتلة المولية 166.0028 غ/مول المظهر بلورات بيضاء الكثافة 3.123 غ/سم3 نقطة الانصهار 681 °س نقطة الغليان 1330 °س الذوبانية في الماء 128 غ/100 مل ماء الذوبانية ينحل في الإيثانول والأسيتون المخاطر توصيف المخاطر لا يوجدتحذيرات وقائية لا يوجدفي حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) تعديل مصدري – تعديل 
يوديد البوتاسيوم مركب كيميائي غير عضوي له الصيغة KI، ويكون على شكل بلورات بيضاء.
وهو أهم مركبات اليوديد من الناحية التجارية حيث أنتج منه ما يقارب 37000 طن عام 1985، أقل استرطاب من يوديد الصوديوم مما سهل العمل عليه، يوديد البوتاسيوم متوفر للحاجات الطبية الطارئة بأقراص 130 ملغ
يتحلل محلول يوديد البوتاسيوم كهربياً ليتصاعد غاز الهيدروجين عند المهبط (اختزال) ويتكون اليود عند المصعد (أكسدة) ويذوب اليود الناتج في محلول يوديد البوتاسيوم ليتكون محلول ذو لون بني.
2H + 2e → H2
الاستخدام
يستحدم محلول يوديد البوتاسيوم المخلوط مع عنصر اليود الصلب وذالك لصناعة محلول مدرق الذي يعمل عمل الغدة الدرقية حال عدم افراز اليود أو نقصه أو حال استئصالها جذريا ولتحضير كمية صغيرة 50 مليلتر من هذا المحلول المدرق نحضر50 مليلتر من الماء النقي المقطر ونضع 2 جرام من يوديد البوتاسيوم الصلبة KI ثم الحرك والخلط الجيد وبعد انتهاء الخلط نضع 1 جرام من اليود الصلب ثم يتم الحرك الجيد فيصبح محلول جاهز للاستخدام. يستخدم من هذا المحلول المدرق 5 قطرات فقط يوميا في كمية لتر من الحليب أو الماء لا يحتاج لمواد حافظة كذالك يستخدم هذا المحلول المدرق للكشف عن النشاء ويستخدم في محطات تحلية المياة ومحطات المياة استخدام هذا المحلول بمقدار 5 قطرات بداخل 5 لتر من الماء الصالح للشرب وذلك لضمان عدم ارهاق غددنا الدرقية في افراز اليود كما ان المحاليل المدرقة هامة جدا في الاغذية الصحية المعلبه استخدمه بيطريا في تجاربه على الطيور والحيوانات حيث ان هذا المحلول المدرق يخلص الطيور والحيوانات من الطفيليات العالقة على اجسامهن دون أن يسبب اي اذى للطيور والحيوانات وكذالك استخدمه في أحواض مياه السمك وذلك لا زاله الفطريات وقتل الجراثيم المؤكسدة في الحوض كذلك يستخدم جراحيا حال استئصال الغدة الدرقية وذلك لتقليل فقدان الدم خلال قطع الغدة الدرقية يجب أن يحفظ المحلول المدرق في عبوات قطرات علاجية اقل من 10 مليلتر وذلك للاحتياط من عدم شرب المحلول المدرق بدون تخفيف لانه يعمل افات في اللسان والمرئ والمعدة وكذلك لاخذ الاحتياط من عدم تناول جرعة كبيرة وذلك لان الجرعة أكبر من 14 مليلتر دفعة واحدة تسبب الوفاة.
أقراص لوغول
هي وسيلة للوقاية من اليود الإشعاعى ويتم توزيعها على السكان المتواجدون بجوار المفاعلات الاشعاعية خوفا من الاصابة بالتسرب الاشعاعى.
وظيفة تلك الاقراص هي منع الإصابات الخطيرة الناجمة عن الإشعاعات ذات النشاط الإشعاعي عن طريق الغدد الدرقية في جسمنا. وتحتوي أقراص لوغول على 130 غرام من المادة الفعّآلة يوديد البوتاسيوم.
- يوديد الفضة
- يوديد الكادميوم