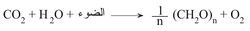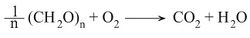تفاعلات كيميائية ضوئية
تفاعلات كيميائية ضوئية photochemical reactions :
أي تفاعل كيميائي يتم فيه انتاج ضوء أو يبدأ نتيجة لتعرضه للضوء . و الضوء يمكن ان يبدأ التفاعلات من خلال إثارة الذرات او الجزيئات و يجعلها أكثر اثارة و فعالية ، فالطاقة الضوئية يتم تحويلها إلى طاقة كيميائية . فالعديد من التفاعلات الكيميائية الضوئية تتم عبر سلسلة من التفاعلات و ينتج عنها شقوق حرة . و يمكن ملاحظة مثل هذا النوع من التفاعلات في تفاعلات تقصير لأصباغ او من خلال ملاحظة اصفرار الورقة البيضاء عند تعرضها للضوء . و هذه لتفاعلات تسخر في النباتات في عملية البناء الضوئي و الأنسان استفاد منها في عمليات التصوير الفوتوغرافي . و يمكن ملاحظة التفاعلات الكيميائية التي تصدر ضوءً عند حرق المواد . و تستخدم التفاعلات الكيميائية المشعة للضوء من قبل الكائنات الحية حيث الوميض الحيوي.
الكيمياء الضوئية العضوية وغير العضوية الفلزية
التألق الضوئي
التألق هو إصدار إشعاع مرئي أو غير مرئي بدرجة الحرارة العادية من أي مادة نتيجة امتصاص طاقة مهيِّجة على شكل فوتونات، أو جسيمات مشحونة أو تحوّل كيمياوي. والتألق luminescence، مصطلح عام يتضمنالتفلور fluorescence والفسفرة phosphorescence. ففي التفلور يصدر الجزيء أو الذرة إشعاعاً مرئياً بالانتقال من سوية إلكترونية ذات طاقة عالية إلى سوية طاقية أخفض. وتكون المدة الفاصلة بين امتصاص الطاقة وإصدارها صغيرة جداً لاتتجاوز 10-8 إلى 10-3 ثانية. وبهذا يختلف التفلور عن الفسفرة التي قد يمتد الفاصل الزمني بين الامتصاص والإصدار فيها من 01-6ثا إلى أيام عدة. المواد المتفلورة قد تكون سائلة أو صلبة، عضوية أو لا عضوية. أما في الفسفرة، فتكون المادة المهيَّجة بلورية أو سائلة، ويستمر سبب الإصدار بعد إزالة سبب التهييج، وقد تدوم لفترة أجزاء من الثانية أو لمدة ساعة أو أكثر. وهذه الخاصة تحدث في بعض المركبات العضوية، وتتم أيضاً في العديد من المركبات اللاعضوية الصلبة.
التحليل الضوئي الومضي
يطلق اسم التحليل الضوئي الومضي flash photolysis على طريقة تتَّبع لدراسة آلية التفاعلات الكيمياوية الضوئية التي يدخل فيها تكون جذور radicals حرة (عضوية أو لاعضوية)، وذلك بتسليط ومضة من ضوء شديد على مزيج التفاعل، فتتشكل جذور حرّة تنشِّط التفاعلات الكيمياوية الضوئية. وتُحلَّل نواتج التفاعل في الحال بطريقة طيفية، وبذلك يمكن معرفة الجذور الحرة من الطيف. والجذر الحر هو شدفة من جزيء فيها إلكترون حر واحد أو أكثر ويكون عمره قصيراً ويكون شديد الفعّالية. ومن المتعارف أن يشار إلى الجذر الحر بوضع نقطة على رمزه مثل Cl*، أو صيغته مثل (C2H5)*. وتتكون الجذور الحرة بفصم عرى الرابطة الجزيئية. وتعمل الجذور الحرة على حصول التفاعل أو تكوُّن مركبات وسطية في عمليات رئيسية مثل الأكسدة، والتحليل الضوئي والتماثر (التبلمر).
وتستعمل هذه الطريقة في التفاعلات السريعة جداً التي تحدث في المتفجرات وفي ألسنة اللهب؛ فإذا أخضعت المنظومة (الجملة) المتفاعلة إلى نبضة ضوئية ذات طاقة عالية لفترة زمنية قصيرة، كما يحدث عادة لدى تفريغمكثف كهربائي مشحون في أنبوب انفراغ مناسب، فإن الجزيئات كافة في أنبوب الانفراغ، عملياً، تتفكك إلى جذور حرة ويمكن الحصول على نبضات ضوئية من مرتبة 50 ميغا واط MW لبضعة مكرو ثواني، وقد تم تحديد تراكيز مواد مهمة مثل (NH2)* و(ClO)* و(CH3)* بهذه التقنيات الكيمياوية الضوئية.
التصوير الضوئي
من المعروف أن تعريض ملح مثل كلوريد الفضة إلى ضوء الشمس، يؤدي إلى تغير لونه الأبيض إلى الرمادي تدريجياً، بفعل امتصاص فوتونات الضوء الشمسي، فإذا مزج كلوريد الفضة AgCl أو بروميد الفضة AgBr مع الجيلاتين وعرِّض المزيج إلى الضوء لفترة قصيرة، لا يلاحظ حدوث شيء ولكن عند وضع هذا المستحلب في محلول مادة مرجعة ضعيفة mild reducing agent مثل حمض بيروغالّول pyrogallic acid فإن تلك الأجزاء من المستحلب التي عرضت للضوء (ولو لفترة قصيرة) سوف ترجَع إلى ذرات الفضة المعدنية، أسرع بكثير من الأجزاء التي لم يصلها الضوء. وبذلك يمكن تشكيل صورة لجسم ما تصدر مناطقه مقادير مختلفة من الضوء من نقاطها المختلفة. وتتألف لوحة التصوير (فيلم التصوير) من كميات كبيرة من قسيمات من بلورات هاليدات الفضة (مركبات الفضة مع الهالوجينات وأساساً مع الكلور والبروم). وعندما ترجع كميات الهاليدات كافة إلى الفضة المعدنية، يسود الفيلم تماماً، في حين لا تسود الأماكن من الفيلم التي لم تتعرض إلى إشعاعات الضوء. يمكن إزالة كامل كميات الهاليدات هذه بإذابتها في محلول ثيوكبريتات الصوديوم المعروف تجارياً باسم (الهيبو)، وتكون إزالة الهاليدات متناسبة مع كمية الضوء الواصل إلى سطح لوحة التصوير، ولذلك تتضح بعد إظهار الفيلم مناطق مختلفة الاسوداد، من السواد التام إلى الشفافية التامة، وبذلك يحصل على الصورة السلبية للجسم المراد تصويره، وبعملية تصوير تالية يمكن الحصول على الصورة العادية. ويمكن زيادة حساسية فيلم التصوير لكي يصبح قادراً على التعامل مع استطاعات ذات طاقة صغيرة بتصغير أبعاد الهاليدات إلى الدرجة المطلوبة لكي تصبح قادرة على الاستجابة لهذه الإشعاعات الضوئية الضعيفة. تكون هاليدات الفضة حساسة خاصة إلى الإشعاعات ذات طول الموجة الصغير من طيف الضوء المرئي وإلى الإشعاعات فوق البنفسجية UV، ولكن إضافة بعض الأصبغة إلى مستحلب هذه الهاليدات مثل صباغ ديسيانين dicyanin يجعَل الفيلم حساساً حتى للأشعة تحت الحمراء، الأمر الذي يجد تطبيقات مهمة جداً إذا عرف أن جميع المواد تصدر إشعاعات تحت حمراء حتى في درجات الحرارة العادية والدنيا.
الاصطناع الضوئي
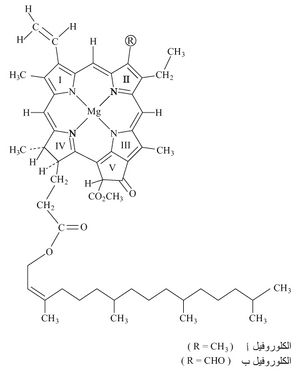
يعد الاصطناع الضوئي photosynthesis الذي يقوم به الغطاء النباتي على سطح الأرض والذي يؤدي إلى إنتاج الغذاء للكائنات الحية كافة، أكثر التفاعلات الكيميائية الضوئية أهمية. ويتم هذا الاصطناع باتحاد ثنائي أكسيد الكربون CO2 مع الماء لإنتاج الغذاء في النبات الأخضر، وذلك بوجود الكلوروفيل (اليخضور) chlorophyll وضوء الشمس. يعطي الكلوروفيل النباتاتِ لونَها الأخضر، وهو مركب عضوي معقد يحتوي على ذرات المغنزيوم، وهو موجود في النباتات كافة عدا الفطور fungi، والبكتريا bacteria. وله ثلاثة أشكال (أ وب وجـ)، وجميعها ضروب بورفرين porphyrins فيها مغنزيوم في الوسط. يستقبل الكلوروفيل الأشعة التي تصل أطوالها إلى 700 ميليمكرون (mμ)؛ ووظيفته في الاصطناع الضوئي تحويل الطاقة الشمسية إلى طاقة كيمياوية. وهو بنيوياً يشبه بنية الهيمين (الصباغ) الذي يمنح الدم لونه الأحمر.
الكلوروفيل (أ) صيغته كما هو مبيَّن في الشكل (1) C55H72MgN4O5 درجة انصهاره 117-120 ْس والكلوروفيل (ب) صيغته C55H70MgN4O6.
يمتص الكلوروفيل الإشعاعات الضوئية الحمراء والزرقاء أساساً، وكذلك يمتص الإشعاعات الخضراء ولكن بدرجة أقل. ويؤدي هذا الامتصاص إلى تشكل الكلوروفيل المهيَّجexcited chlorophyll، وهو المسؤول عن إنتاج كامل المواد اللازمة لبناء العالم النباتي على وجه البسيطة ويرمز لذلك بالتفاعل الآتي:
حيث يدل الرمز CH2O على المركبات الكربوهيدراتية (مائيات الفحم)، والتي يمثلها السلولوز، ويتم الحصول على حرارة وفق التفاعل الآتي:
وتنتج من حرق مول واحد (جزيء غرامي واحد) من المادة المذكورة كمية حرارة قدرها 112كيلو حريرة. وهذا يعني أن التفاعل الماص للحرارة endothermic reaction الموافق لتشكل الكربوهيدرات من الماء وغاز CO2 يحتاج إلى امتصاص طاقة تساوي 112كيلو حريرة/مول. وهي الطاقة التي يوفرها امتصاص فوتونات الإشعاع الشمسي. توافق هذه الطاقة إشعاعاً ضوئياً طول موجته مساوٍ أو أصغر من 230نانومتر (nm). ولكن الإشعاع الشمسي لا يحتوي على هذا النوع من الإشعاعات المدعوة بالإشعاع فوق البنفسجي البعيد، لدى وصوله سطح الأرض، لكن الكلوروفيل يتمكن من إحداث الاصطناع الضوئي بامتصاصه أشعة الطيف المرئي من ضوء الشمس، ومن ثم إتمام عملية هذا الاصطناع عبر مراحل متعددة ومعقدة في النباتات. فعلى الرغم من أن النباتات تمتص الضوء الأحمر، وطاقته لا تتجاوز مقدار 40كيلو حريرة/مول، فإن هذا الامتصاص يمكِّن الكلوروفيل من إنتاج الكربوهيدرات المذكورة (وهو أمر فريد في نظام هذا الكون) ذلك أن تفاعل الاصطناع السابق يحتاج إلى 112كيلو حريرة/المول.
تشكل الأوزون
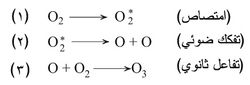
يتكوّن الأوزون O3 في طبقات الجو العليا من جزيئات غاز الأكسجين العادي O2 حسب التفاعل:
فبعد امتصاص كمّ من الإشعاع فوق البنفسجي (الخطوة 1)، يتفكك جزيء الأكسجين إلى ذرتي أكسجين (الخطوة 2). وتتفاعل ذرة الأكسجين مع O2 لتشكل الأوزون (الخطوة 3).
تحطم الأوزون في طبقات الستراتوسفير العليا
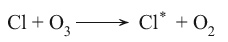
تستعمل بعض ضروب مركبات الكلوروفلورميتان مثل CCl3F وCCl2F2 موادَ مبرِّدة. وهذه المركبات تنفذ إلى الستراتوسفير، حيث يطرأ عليها تفكك ضوئي، وتنتج ذرات Cl التي تتفاعل مع جزيئات الأوزون حسب التفاعل:
وهذا التناقص في المحتوى الأوزوني بطبقات الجو العليا يؤدي إلى وصول أشعة فوق بنفسجية أكثر إلى سطح الأرض.
التفاعلات المتسلسلة
إذا أدت العملية الكيمياوية الأولية إلى تفكك جزيء وتحوله إلى جذور، فالعملية الثانوية قد تؤدي إلى تفاعل متسلسل. والتفاعل المتسلسل هو عملية حلقية حيث يهاجم جذرٌ فعّال جزيئاً فينتج جذر غير فعّال آخر. وهذا الجذر الجديد يهاجم جزيئاً آخر فيترمم بذلك الجذر الأصلي، وتبدأ الحلقة من جديد.
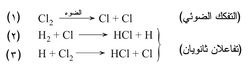
وتفاعل الهدروجين مع الكلور هو مثال على التفاعل المتسلسل. وإن التفاعل الكلي الحاصل بين غازي الهدروجين والكلور بوجود الأشعة البنفسجية أو فوق البنفسجية هو تكوّن كلوريد الهدروجين HCl:
يجري هذا التفاعل في الواقع حسب الخطوات الآتية:
فحسب هذه الآلية، يفكك كمّ مناسب من الضوء جزيءَ الكلور (الخطوة 1) إلى ذرتين، وتهاجم ذرةُ الكلور جزيءَ الهدروجين فيتكون كلوريد الهدروجين وذرة هدروجين (الخطوة 2). ثم تهاجم ذرة الهدروجين الفعالة جزيءَ كلور فتتكون ذرة كلور (الخطـوة 3). تتفاعل ذرة الكلور الفعالة هذه ثانية مع جزيء هدروجين آخر من جـديد (الخطـوة 2) فتبدأ بذلك حلـقة خطوات جـديدة. تجري الخطوات 2 و3مرات كثيرة إلى أن تستهلك إحدى المادتين المتفاعلتين H2 وCl2 أو إلى أن يهاجم جذر H أو جذر Cl مادة جديدة أُدخلت إلى حجرة التفاعل.
أنابيب الكربون النانوية